Enorme stap: wetenschappers verwijderen ernstige erfelijke ziekte uit embryo
Voor het eerst zijn wetenschappers erin geslaagd om veilig en succesvol menselijke embryo’s te ontdoen van een ernstige erfelijke ziekte. Met behulp van een spraakmakende genetische knip-en-plaktechniek wisten ze een mutatie te corrigeren die een veelvoorkomende hartafwijking veroorzaakt.
Door: Ellen de Visser 2 augustus 2017, 19:00
Door zo vroeg in het leven in te grijpen, worden veranderingen in het dna definitief, en doorgeven aan het nageslacht. Het kan het begin zijn van een toekomst, schrijven de onderzoekers, waarin we verlost worden van duizenden erfelijke ziekten.
‘Als we een van de embryo’s zouden terugplaatsen in de baarmoeder, zou dat waarschijnlijk een gezond kind opleveren’, zegt Sjoerd Repping, hoogleraar humane voorplantingsbiologie aan het AMC. Terugplaatsen van genetisch veranderde embryo’s is nu nog verboden, althans in de landen die wettelijke regels hebben opgesteld. De gebruikte techniek is omstreden en roept wereldwijd ethische bezwaren op. De vrees bestaat dat de mens ermee voor God gaat spelen en dat aanpassingen aan embryo’s veel verder zullen gaan dan alleen het uitbannen van ernstige aangeboren ziektes. Nu blijkt dat de methode veilig en efficiënt kan worden toegepast, wordt het tijd voor een discussie over de wenselijkheid, meent Repping. ‘In landen zonder regelgeving kan deze techniek morgen worden toegepast. Dan gaan echtparen naar het buitenland. Deze ontwikkeling valt niet tegen te houden.’
De eerste (minder succesvolle) onderzoeken bij menselijke embryo’s zorgden voor internationale opschudding. Daarom zijn de wetenschappers, afkomstig uit onderzoeksinstellingen en laboratoria in de Verenigde Staten, China en Zuid-Korea, enthousiast maar ook voorzichtig. Er is nog veel meer onderzoek nodig voordat die genbewerking in de kliniek kan worden ingezet, schrijven ze in de persberichten bij hun studie, die woensdagavond is gepubliceerd in vakblad Nature. Daarbij moeten ethische overwegingen en sociale consensus volop de aandacht krijgen.
Dna-reparatie
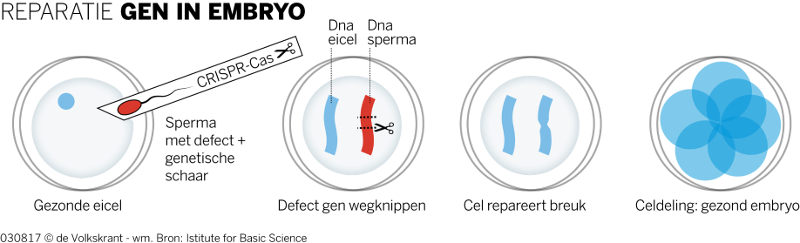
De wetenschappers hanteerden de zogeheten CRISPR-Cas-methode, een vorm van genetische chirurgie die het dna in de cel repareert. Die techniek maakt gebruik van een eiwit dat zo kan worden geprogrammeerd dat het precies naar de plek toegaat waar het dna een mutatie bevat en het daar doormidden knipt. De cel repareert daarna vaak zelf de breuk waarbij de mutatie wordt gecorrigeerd.
Voor hun onderzoek gebruikten de wetenschappers gezonde eicellen die ze bevruchtten met het sperma van een donor met de hartafwijking hypertrofische cardiomyopathie. Bij die erfelijke aandoening is een deel van de hartspier verdikt waardoor minder bloed kan worden rondgepompt. De ziekte, die een op de vijfhonderd mensen treft, openbaart zich pas op volwassen leeftijd. Het is de meest voorkomende plotse doodsoorzaak bij jonge atleten. Omdat de aandoening wordt veroorzaakt door een mutatie in één gen, is het bij uitstek geschikt voor het gebruik van CRISPR-Cas: de schaar hoeft dan steeds maar naar één plek in het dna te worden gedirigeerd.
De onderzoekers ontdekten een reparatiemechanisme waarbij de cellen het gezonde gen uit de eicel als een soort blauwprint gebruikten
Bij alle onderzochte embryo’s deed de schaar op de juiste plek zijn werk. Bij de helft was de dna-breuk daarna goed hersteld. De onderzoekers ontdekten een reparatiemechanisme dat uniek is voor vroege embryo’s. De cellen gebruikten daarbij het gezonde gen uit de eicel als een soort blauwprint, legt Repping uit.
Misschien nog wel belangrijker: de schaar was nergens uitgeschoten, en juist dat was de afgelopen jaren de grootste zorg van genetici. Wat als elders in het dna breuken zouden ontstaan doordat de schaar iets te wild om zich heen greep? Dan zou een techniek die een genetisch probleem moest oplossen nieuwe problemen creëren. Na uitvoerige controle van alle embryo’s bleek daarvan geen sprake.
Embryoselectie
De embryo’s waren bovendien ook nog eens allemaal compleet gezond, wat bij eerdere, kleinschalige, studies niet het geval was. De embryo’s kwamen toen niet ongeschonden door de genetische chirurgie heen. Er ontstonden embryo’s met een mozaïekpatroon, waarbij sommige cellen wel en andere niet de ziekmakende mutatie droegen. Dat komt vermoedelijk doordat de genetische schaar iets te laat werd gehanteerd, net na de bevruchting, toen de cel al aan het delen was geslagen. Nu injecteerden de wetenschappers het sperma en de schaar op hetzelfde moment in de eicel. Nog voordat de bevruchte cel begon te delen, was het genetische defect gerepareerd.
Jaarlijks doen we 1500 embryo’s weg waarvan we er straks mogelijk 750 alsnog kunnen gebruiken
– Hoogleraar Sjoerd Repping
De techniek kan van waarde zijn voor ouders die, bijvoorbeeld door een eerder sterfgeval, weten dat er een ernstige ziekte in de familie zit, en om die reden voor ivf met geselecteerde embryo’s kiezen. Daarbij worden embryo’s vóór terugplaatsing genetisch gecontroleerd, waarbij gemiddeld de helft noodgedwongen wordt weggedaan omdat die de erfelijke afwijking dragen. Als straks de helft van die afgedankte embryo’s kan worden hersteld, geeft dat veel winst, zegt Repping.
Jaarlijks worden in vier Nederlandse centra vijfhonderd van die speciale ivf-behandelingen met embryoselectie uitgevoerd, waarbij gemiddeld zes embryo’s worden gebruikt. ‘Dat betekent dat we jaarlijks 1500 embryo’s wegdoen waarvan we er straks mogelijk 750 alsnog kunnen gebruiken. Dat is nogal wat.’ Er zijn ook ouders met pech, benadrukt hij, bij wie door toeval alle embryo’s een afwijking hebben. ‘Ik kan me voorstellen dat zij zich gaan roeren. Als zij met lege handen staan terwijl er een techniek bestaat die hun mogelijk een gezond kind kan bieden, dan zullen ze daarom gaan vragen.’
Bron: de Volkskrant